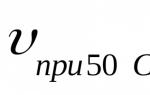Скорость химической реакции урок. Открытый урок по дисциплине "химия" на тему "скорость химических реакций"
О.И. Иванова, учитель химии МБОУ «Напольнокотякская СОШ» Канашского района ЧР
Урок " Факторы, влияющие на скорость химической реакции"
Цель урока: изучение факторов, влияющих на скорость химической реакции
Задачи:
узнать, какие факторы влияют на скорость химических реакций
научить объяснять влияние каждого фактора;
стимулировать познавательную активность учащихся путём создания проблемной ситуации;
формировать компетенции школьников (учебно-познавательную, коммуникативную, здоровьесбережения);
совершенствовать практические умения учащихся.
Тип урока: проблемно-диалогический.
Формы работы: групповая, индивидуальная.
Оборудование и реактивы: набор пробирок, держатель для пробирок, штатив, спиртовка, лучинка, спички, цинк в гранулах, цинк в порошке, оксид меди в порошке, магний, раствор серной кислоты (10 % -ный раствор), пероксид водорода, дихромат калия, сульфат меди, железный гвоздь, гидроксид натрия, мел.
Ход урока:
1-и этап:
Вызов: Здравствуйте, ребята! Сегодня мы с вами представим себя учёными- исследователями. Но прежде, чем мы приступим к изучению нового материала, мне хотелось бы продемонстрировать небольшой эксперимент. Посмотрите, пожалуйста, на доску и сделайте свои предположения по поводу протекания этих реакций:
А)сульфата меди и железа;
Б)раствора сульфата меди и гидроксида калия
Будут ли протекать эти реакции? Выйдите, пожалуйста, к доске и напишите уравнения этих реакций.
Рассмотрим эти примеры (эксперимент проводит учитель).
На столе - две пробирки, в обоих содержится раствор сульфата меди, но в одной пробирке с добавлением хлорида натрия, в обе пробирки опускаем по грануле алюминия. Что мы наблюдаем?
ПРОБЛЕМА: Почему во втором случае мы не видим признаков реакции, неужели наши предположения неверны?
ВЫВОД : Химические реакции протекают с различными скоростями. Одни идут медленно, месяцами, как, например, коррозия железа или ферментация (брожение) виноградного сока, в результате которой получается вино. Другие завершаются за несколько недель или дней, как, например, спиртовое брожение глюкозы. Третьи заканчиваются очень быстро, например осаждение нерастворимых солей, а некоторые протекают мгновенно, например взрывы.
Практически мгновенно, очень быстро идут многие реакции в водных растворах: это ионные реакции, идущие с образованием осадка, газа или реакции нейтрализации.
А теперь вспомним, что вам известно о скорости химических реакций.
Осмысление понятия. Перечисляют определение, формулы, единицу измерения.
ПРОБЛЕМА: Что нужно знать, чтобы уметь управлять скоростью химической реакции? (Знать, какие условия влияют на скорость)
Как называются эти условия, которые вы сейчас перечислили? (Факторы)
Перед вами на столах стоят химические приборы и реактивы. Как вы думаете, с какой целью вы будете проводить опыты? (С целью изучения влияния факторов на скорость реакций)
Теперь мы с вами подошли к теме сегодняшнего урока. Именно изучением факторов мы будем заниматься на этом уроке.
Пишем в тетрадях название темы и дату.
II этап:
ОСМЫСЛЕНИЕ СОДЕРЖАНИЯ.
Какие же факторы влияют на скорость химических реакций?
Учащиеся перечисляют: температура, природа реагирующих веществ, концентрация, поверхность соприкосновения, катализаторы.
Как они могут изменить скорость реакции? (Ученики предлагают свои предположения)
Учитель: Влияние всех перечисленных факторов на скорость химических реакций можно объяснить, используя простую теорию - теорию столкновений. Основная ее идея такова: реакции происходят при столкновении частиц реагентов, которые обладают определенной энергией. Отсюда можно сделать такие выводы:
Чем больше частиц реагентов, тем больше у них шансов столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие, при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать определенной энергией.
Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации (запись определения в тетрадях).
Таким образом, на пути всех частиц, вступающих в реакцию, имеется некоторый барьер, равный энергии активации. Если он маленький, то находится много частиц, которые его успешно преодолевают. При большом энергетическом барьере необходима дополнительная энергия для его преодоления, иногда достаточно «хорошего толчка».
Обращаемся к высказыванию Леонардо да Винчи (Знания, не проверенные опытом, бесплодны и полны ошибок).
Учитель: Как вы понимаете значение этих слов? (проверять теорию практикой)
Да, действительно, всякую теорию надо проверять еще и на практике. Далее вам самим предстоит изучение различных факторов на скорость реакций. Для этого вы проведете реакции, руководствуясь инструкциями на ваших столах, оформите протокол опыта. После этого одному учащемуся из группы надо будет выйти к доске, объяснить, влияние какого фактора вы рассмотрели, написать уравнения на доске и сделать вывод согласно теории столкновений и теории активации.
Инструктаж по ТБ.
ПРОВЕДЕНИЕ ПРАКТИЧЕСКОЙ РАБОТЫ В ГРУППАХ
Карточка 1.Факторы, влияющие на скорость химической реакции:
1. Природа реагирующих веществ .
В две пробирки налейте немного серной кислоты.
2. В одну опустите небольшое количество магния, а в другую - гранулу цинка.
3. Сравните скорость взаимодействия различных металлов с серной кислотой.
4. В чём, по вашему мнению, причина различной скорости реакций кислоты с данными металлами.
5. Влияние какого фактора вы выяснили при проведении этой работы?
6. Найдите в протоколе лабораторной работы полуреакции, соответствующие вашему опыту, и допишите уравнения реакций.
Карточка 2. Факторы, влияющие на скорость химической реакции:
2.Концентрация реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
1. В две пробирки налейте 1-2 мл серной кислоты.
2. В одну из пробирок добавьте такой же объем воды.
3. В каждую из пробирок поместите гранулу цинка.
4. В какой из пробирок выделение водорода началось быстрее?
Карточка 3. Факторы, влияющие на скорость химической реакции:
3.Площадь соприкосновения реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
1. Разотрите небольшой кусочек мела в ступке.
2. В две пробирки налейте немного раствора серной кислоты. Будьте очень осторожны, налейте совсем немного кислоты!
3. Одновременно в одну пробирку поместите порошок, а в другую кусочек мела.
4. В какой из пробирок реакция пройдёт быстрее?
5. Влияние какого фактора вы выяснили в этом эксперименте?
6. Как это можно объяснить с точки зрения теории столкновений?
7. Напишите уравнение реакции.
Карточка 4. Факторы, влияющие на скорость химической реакции:
4.Температура.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
1. В обе пробирки налейте раствор серной кислоты и поместите в них по грануле оксида меди.
2. Одну из пробирок осторожно нагрейте. Сначала нагреваем пробирку чуть наклонно, стараясь прогреть ее по всей длине, затем только нижнюю часть, уже выпрямив пробирку. Пробирку держите держалкой.
3. В какой из пробирок реакция протекает более интенсивно?
4. Влияние какого фактора вы выяснили в этом эксперименте?
5. Как это можно объяснить с точки зрения теории столкновений?
6. Напишите уравнение реакции.
Карточка 5. Факторы, влияющие на скорость химической реакции:
5.Наличие специальных веществ- катализаторов , веществ, которые увеличивают скорость химической реакции.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В два стаканчика налейте перекись водорода.
В одну из пробирок осторожно присыпьте несколько кристалликов дихромата калия. Перемешайте полученный раствор стеклянной палочкой.
Зажгите лучинку, а потом погасите её. Поднесите тлеющую лучинку к растворам в обоих стаканах как можно ближе к раствору, но не касаясь жидкости. Лучинка должна загореться.
В какой из пробирок наблюдается бурное выделение газа? Какой это газ?
Какую роль в этой реакции выполняет дихромат калия?
Влияние какого фактора вы выяснили в этом эксперименте?
Напишите уравнение реакции.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ.
Для обсуждения из каждой рабочей группы к доске выходит по одному ученику (по очереди)
Составление сводного протокола лабораторной работы на основе ответов к вопросам практикума.
На доске пишут уравнения реакций и делают соответствующие выводы. Все остальные учащиеся заносят полученные выводы и уравнения в протоколы.
Влияние природы реагирующих веществ
Проблема:
Учитель: массы взятых веществ навесок твёрдых веществ, концентрация соляной кислоты, условия проведения реакции одинаковы, но при этом интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учащиеся: мы брали разные металлы.
Учитель: все вещества состоят из атомов химических элементов. Чем отличаются химические элементы согласно знанию вами Периодического закона и Периодической системы Д. И. Менделеева?
Учащиеся: Порядковым номером, положением в Периодической системе Д. И. Менделеева, то есть они имеют различное электронное строение, а следовательно простые вещества образованные этими атомами имеют различные свойства.
Учитель: то есть эти вещества имеют различную природу. Таким образом, скорость химической реакции будет зависеть от природы того или иного реагирующего вещества, т. к. они имеют различное строение и свойства.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от природы реагирующих веществ: чем активнее металл (вещество), тем выше скорость химической реакции.
Влияние концентрации
Проблема: природа всех реагирующих веществ, условия проведения опыта одинаковы, однако интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учитель: почему скорость химической реакции разная, ведь реагируют одинаковые по химической природе вещества?
Учащиеся: При добавлении воды, мы изменили (уменьшили) концентрацию серной кислоты в одной пробирке, при этом интенсивность выделения водорода уменьшалась.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от концентрации реагирующих веществ: чем больше концентрация реагирующих веществ, тем выше скорость химической реакции.
Пояснение учителя: КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать. На основе большого экспериментального материала в 1867г. норвежские учёные К.Гульдберг и П.Вааге и независимо от них в 1865 г. русский учёный Н.И.Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют законом действующих масс. Он справедлив только для газообразных и жидких веществ!
2А+3В=А2В3 V=k*CA2*.CB3
Задание 1. Составьте кинетические уравнения для следующих реакций:
Задание 2.
Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA2CB, если концентрацию вещества А увеличить в 3 раза.
Зависимость от площади поверхности реагирующих веществ
Проблема:
Учитель: все вещества одинаковы по своей химической природе, одинаковы по массе и концентрации, реагируют при одинаковой температуре, однако интенсивность выделения водорода (а следовательно и скорость) разная.
Обсуждение:
Учащиеся: Одинаковые по массе кусочек и порошок мела имеют разные занимаемые объемы в пробирке, разную степень измельчения. Там где эта степень измельчения наибольшая - скорость выделения водорода максимальна.
Учитель: эта характеристика - площадь поверхности соприкосновения реагирующих веществ. В нашем случае различна площадь поверхности соприкосновения карбоната кальция с раствором Н2SO4.
Вывод:
Учащиеся: Скорость химической реакции зависит от площади соприкосновения реагирующих веществ: чем больше площадь соприкосновения реагирующих веществ (степень измельчения), тем больше скорость реакции.
Учитель: такая зависимость наблюдается не всегда: так для некоторых гетерогенных реакций, например, в системе Твердое вещество - Газ, при очень высоких температурах (более 500 0С) сильно измельчённые (до порошка) вещества способны спекаться, тем самым площадь поверхности соприкосновения реагирующих веществ уменьшается.
Влияние температуры
Проблема:
Учитель: взятые для эксперимента вещества имеют одинаковую природу, масса взятого порошка CuO и концентрация серной кислоты также одинаковы, однако скорость реакции разная.
Обсуждение:
Учащиеся: Значит, при изменении температуры реакции мы изменяем и ее скорость.
Учитель: Значит ли это, что при повышении температуры будет увеличиваться скорость всех химических реакций?
Учащиеся: Нет. Некоторые реакции идут при очень низких и даже минусовых температурах.
Вывод:
Учащиеся: Следовательно, любое изменение температуры на несколько градусов будет в разы изменять скорость химической реакции.
Учитель: Практически так звучит закон Вант-Гоффа, который будет здесь действовать: При изменении температуры реакции на каждые 10 ºС скорость химической реакции изменяется (увеличивается или уменьшается) в 2-4 раза.
Пояснение учителя: ТЕМПЕРАТУРА
Чем больше температура, тем больше активных частиц, увеличивается скорость их движения, что приводит к увеличению числа соударений. Скорость реакции возрастает.
Правило Вант-Гоффа:
При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где V 1 -скорость реакции при температуре t 2 ,
V 2 - скорость реакции при температуре t 1 ,
y - температурный коэффициент.
Решите задачу:
Определите, как изменится скорость некоторой реакции при повышении температуры от 10 до 500С. Температурный коэффициент реакции равен 3.
Решение:
подставить данные задачи в формулу:

скорость реакции увеличится в 81 раз.
Влияние катализатора
Проблема:
Учитель: вещество в обоих случаях одно и то же, природа одинаковая, при одной и той же температуре, концентрация реагента одинаковая, почему же скорость разная?
Обсуждение:
Учитель: Такие вещества, ускоряющие химические реакции, называются катализаторами. Существуют вещества, замедляющие реакции, называются они ингибиторами.
Вывод:
Ученики: катализаторы увеличивают скорость реакции за счет уменьшения энергии активации. Чем меньше энергия активации, тем быстрее реакция.
Каталитические явления широко распространены в природе: дыхание, усвоение питательных веществ клетками, синтез белков и др.- это процессы, регулируемые биологическими катализаторами - ферментами. Каталитические процессы - основа жизни в той форме, которая существует на земле.
Притча «Восемнадцатый верблюд» (для объяснения роли катализатора)
(очень древняя арабская притча)
Жил когда-то на Востоке человек, который разводил верблюдов. Всю жизнь он работал, а когда состарился, то позвал к себе сыновей и сказал:
«Дети мои! Я стал стар и немощен и скоро умру. После моей смерти разделите оставшихся верблюдов так, как я вам скажу. Ты, старший сын, работал больше всех — возьми себе половину верблюдов. Ты, средний сын, только начал мне помогать — возьми себе третью часть. А ты, младший, возьми девятую часть».
Прошло время, и старик умер. Тогда сыновья решили разделить наследство так, как завещал им отец. Они выгнали стадо на большое поле, пересчитали, и оказалось, что в стаде всего семнадцать верблюдов. И нельзя было разделить их ни на 2, ни на 3, ни на 9! Что было делать — никто не знал. Стали сыновья спорить, и каждый предлагал своё решение. И они уже устали спорить, но так и не пришли к общему решению.
В это время ехал мимо путник на своём верблюде. Услышав крик и спор, он спросил: «Что случилось?»
И сыновья рассказали о своей беде. Путник слез с верблюда, пустил его в стадо и сказал: «А теперь разделите верблюдов, как велел отец».
И так как верблюдов стало 18, то старший сын взял себе половину, то есть 9, средний — треть, то есть 6 верблюдов, а младший девятую часть, то есть двух верблюдов. И когда они разделили таким образом стадо, в поле остался ещё один верблюд, потому что 9+6+2 равно 17.
А путник сел на своего верблюда и поехал дальше.
Лабораторная работа (протокол)
| Наблюдения | |||
| Зависимость скорости реакции от природы реагирующих веществ
Zn + H2SO4(10%)= Mg + H2SO4(10%)= | V 1 V 2 | ||
| Зависимость скорости реакции от концентрации реагирующих веществ Zn + H2SO4(10%)= | V 1 V 2 | ||
| Зависимость скорости реакции от площади поверхности реагирующих веществ для гетерогенных реакций
Zn(гранулы)+ H2SO4(10%)= Zn(порошок)+ H2SO4(10%)= | V 1 V 2 | ||
| Зависимость скорости реакции от температуры CuO + H 2 SO 4 (10%)= CuO + H 2 SO 4 (10%) нагрев = | V 1 V 2 | ||
| Зависимость скорости реакции от присутствия катализатора
K 2 Cr 2 O 7 | V 1 V 2 |
РЕФЛЕКСИЯ.
Что мы изучили на этом уроке?
Составьте кластер на тему «Факторы, влияющие на скорость ХР».
Для чего нужны знания о факторах, влияющих на скорость химических реакций?
Применяются ли они в быту? Если применяются, назовите области применения.
Тест по теме (на 5 мин).
Тест
1. Скорость химической реакции характеризует:
1) движение молекул или ионов реагирующих веществ относительно друг друга
2) время, за которое заканчивается химическая реакция
3) число структурных единиц вещества, вступивших в химическую реакцию
4) изменение количеств веществ за единицу времени в единице объема
При повышении температуры реагирующих веществ скорость химической реакции:
1) уменьшается
2) увеличивается
3) не изменяется
4) изменяется периодически
При повышении площади поверхности соприкосновения реагирующих веществ скорость химической реакции:
1) уменьшается
2) увеличивается
3) не изменяется
4) изменяется периодически
При повышении концентрации реагирующих веществ скорость химической реакции:
1) уменьшается
2) увеличивается
3) не изменяется
4) изменяется периодически
Для увеличения скорости химической реакции
2CuS(тв.)
+ 3O
2
(г
.) = 2CuO(тв
.) + 2SO
2
(г
.)
+
Q
необходимо:
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО2
3) уменьшить температуру
4) увеличить степень измельчения CuS
При обычных условиях с наименьшей скоростью происходит взаимодействие между:
3) Zn и HCl (10%-й р-р)
4) Mg и HCl (10%-й р-р)
При увеличении температуры от 10 до 30 °С скорость реакции, температурный коэффициент которой = 3:
1) возрастает в 3 раза
2) возрастает в 9 раз
3) уменьшается в 3 раза
4) уменьшается в 9 раз
Оценка тестовой работы:
Ответы на тест:
Без ошибок - «5»
1-2 ошибки - «4»
3 ошибки - «3»
Домашнее задание:
§13, с. 135-145.
О. С. Габриелян, Г. Г. Лысова. Химия. 11класс. Учебник для общеобразовательных учреждений. 11-е издание, стереотипное. М.: Дрофа, 2009.
Для реакции были взяты вещества при температуре 400С, а затем их нагрели до 700С. Как изменится скорость химической реакции, если температурный коэффициент её равен 2?
Как изменится скорость реакции, протекающей по уравнению 2NO+O2=2NO2, если концентрацию обоих веществ увеличить в 3 раза.
Разделы: Химия
Цель урока
- обучающая: продолжить формирование понятия«скорость химических реакций», вывести формулы для вычисления скорости гомогенных и гетерогенных реакций, рассмотреть от каких факторов зависит скорость химических реакций;
- развивающая: учить обрабатывать и анализировать экспериментальные данные; уметь выяснять взаимосвязь между скоростью химических реакций и внешними факторами;
- воспитательная: продолжитьразвитие коммуникативных умений в ходе парной и коллективной работы; акцентировать внимание учащихся на важности знаний о скорости химической реакции протекающих в быту (коррозия металла, прокисание молока, гниение и др.)
Средства обучения: Д. мультимедийный проектор, компьютер, слайды по основным вопросам урока, CD-диск «Кирилл и Мефодий», таблицы на столах, протоколы лабораторной работы, лабораторное оборудование и реактивы;
Методы обучения: репродуктивный, исследовательский, частично поисковый;
Форма организации занятий: беседа, практическая работа, самостоятельная работа, тестирование;
Форма организации работы учащихся: фронтальная, индивидуальная, групповая, коллективная.
1. Организация класса
Готовность класса к работе.
2. Подготовка к основному этапу усвоения учебного материала. Активизация опорных знаний и умений (Слайд 1, см. презентацию к уроку).
Тема урока «Скорость химических реакций. Факторы, влияющие на скорость химической реакции».
Задача: выяснить, что есть скорость химической реакции, и от каких факторов она зависит. В ходе урока познакомимся с теорией вопроса по вышеназванной теме. На практике подтвердим некоторые наши теоретические предположения.
Прогнозируемая деятельность учеников
Активная работа учащихся показывает их готовность к восприятию темы урока. Нужны знания учащихся о скорости химической реакции из курса 9 класса (внутрипредметная связь).
Обсудим следующие вопросы (фронтально, слайд 2):
- Зачем нужны знания о скорости химических реакций?
- Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
- Как определяют скорость механического движения? Какова единица измерения этой скорости?
- Как определяют скорость химической реакции?
- Какие условия необходимо создать, чтобы началась химическая реакция?
Рассмотрим два примера (эксперимент проводит учитель).
На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO4. Что мы наблюдаем?
Прогнозируемая деятельность учеников
На примерах учащиеся судят о скорости реакций и делают соответствующие выводы. Запись на доске проделанных реакций (двое учащихся).
В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций (два ученика записывают на доске уравнения):
- CuSO 4 + 2КOH = Cu(OH) 2 + К 2 SO 4 ; Cu 2+ + 2OH - = Cu(OH) 2
- Fe + CuSO 4 = FeSO 4 + Cu ; Fe 0 + Cu 2+ = Fe 2+ + Cu 0
Какой вывод по проведённым реакциям мы можем сделать? Почему одна реакция идёт мгновенно, другая медленно? Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
Прогнозируемая деятельность учеников
По результатам демонстрированного эксперимента учащиеся делают вывод: реакция 1 – гомогенная, а реакция
2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
3. Усвоение новых знаний и способов действий (Слайд 3)
Скорость реакции определяется изменением количества вещества в единицу времени
В единице V
(для гомогенной)
На единице поверхности соприкосновения веществ S (для гетерогенной)
Очевидно, что при таком определении величина скорости реакции не зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
Прогнозируемая деятельность учеников
Активные действия учащихся с объектом изучения. Занесение таблицы в тетрадь.
Из этого следуют два важных момента (слайд 4):
2) рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н 2 +О 2 = 2Н 2 О: υ (по Н 2) = 2 υ (по О 2) = υ (по Н 2 О)
4. Закрепление первичных знаний о скорости химической реакции
Для закрепления рассмотренного материала решим расчетную задачу.
Прогнозируемая деятельность учеников
Первичное осмысление полученных знаний о скорости реакции. Правильность решения задачи.
Задача (слайд 5). Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
б) концентрацию вещества В через 20 мин. Решение (приложение 4 , слайд 6).
5. Усвоение новых знаний и способов действий (проведение лабораторной работы в ходе повторения и изучения нового материала, поэтапно, приложение 2).
Нам известно, что на скорость химической реакции влияют разные факторы. Какие?
Прогнозируемая деятельность учеников
Опора на знания 8-9 классов, запись в тетради по ходу изучения материала. Перечисляют (слайд 7):
Природа реагирующих веществ;
Температура;
Концентрация реагирующих веществ;
Действие катализаторов;
Поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Влияние всех перечисленных факторов на скорость реакции можно объяснить, используя простую теорию – теорию столкновений (слайд 8). Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Отсюда можно сделать выводы:
- Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
- К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Е а.
Прогнозируемая деятельность учеников
Осмысливание понятия и запись определения в тетрадь.
Таким образом, на пути всех частиц, вступающих в реакцию, имеется некоторый энергетический барьер, равный энергии активации. Если он маленький, то находится много частиц, которые успешно его преодолевают. При большом энергетическом барьере необходима дополнительная энергия для его преодоления, иногда достаточно хорошего «толчка». Я зажигаю спиртовку – я сообщаю дополнительную энергию Е а, необходимую для преодоления энергетического барьера в реакции взаимодействия молекул спирта с молекулами кислорода.
Рассмотрим факторы , которые влияют на скорость реакции.
1) Природа реагирующих веществ (слайд 9).Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Инструктаж.
Самостоятельная формулировка выводов (приложение 3 дома)
Я слышу – я забываю, я вижу – я запоминаю, я делаю – я понимаю.
Тема урока: Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Цель: углубить и обобщить знания учащихся о скорости химической реакции, о факторах, влияющих на скорость химической реакции;
Задачи:
обучающая: формировать понятия «скорость химических реакций», вывести формулы для вычисления скорости гомогенных и гетерогенных реакций, рассмотреть от каких факторов зависит скорость химических реакций;
развивающая: развивать логическое мышления: умение обрабатывать и анализировать экспериментальные данные, устанавливать взаимосвязь между скоростью химической реакции и внешними факторами.
воспитательная: воспитывать коммуникативных компетенций в ходе коллективной работы; бытовую грамотность.
Средства обучения: мультимедийный проектор, компьютер, программный продукт, лабораторное оборудование и реактивы;
Методы обучения: репродуктивный, исследовательский, частично поисковый;
Форма организации занятий: беседа, исследовательская деятельность, самостоятельная работа.
Форма организации работы учащихся: фронтальная, индивидуальная, групповая.
Тип урока: усвоение знаний на основе имеющихся.
Ход урока:
Обоснование значения изучаемой темы и цели урока.
Вступительное слово учителя: сегодня у нас необычный урок, в ходе работы над сегодняшней темой вы будете составлять кластер, ключевым понятием которого будет тема нашего урока: Скорость химической реакции. Факторы влияющие на скорость химической реакции.
Мы уже познакомились с основными типами химических реакций, научились отличать их от физических явлений по определённым признакам. Убедились, что свойства веществ вступивших в реакцию, отличаются от свойств образовавшихся веществ.
Настало время поговорить о продолжительности химической реакции, т.е. о протекании химического процесса во времени, за которое он происходит. Сегодня мы поговорим о скорости химической реакции, определим факторы, которые влияют на скорость химической реакции.
Актуализация знаний.
Что мы с вами знаем о химических реакциях? (типы реакций, протекают с выделением тепла или наоборот при нагревании; не которые идут быстро, некоторые медленно.)
Скажите, а вы встречались в своей жизни с реакциями идущими очень быстро?
а) горение; б) сода + уксус; в)...
А как вы определили, что они протекают быстро?
А реакции идущие медленно? а) ржавление железа; б) скисание молока;
информация: Для полного гниения брошенной в лесу газеты- 1 год.
Ржавление консервной банки – 10 лет.
Стекло практически не разрушается в течение столетий.
Эти реакции низкой скорости.
Организация деятельности по изучению нового материала.
Скорость химической реакции.
Из курса физики вам известно понятие «скорость движения» (работа по таблице).
| Скорость движения | Единицы измерения скорости |
| Скорость поезда: | |
| Скорость течения реки: | |
| Скорость прокручивания кинопленки: | 24 кадра/с |
| Скорость потребления кислорода человеком: | |
| Скорость реакции: |
Вопрос: Вспомните, что собой представляет скорость механического движения?
Это длина пути, проделанного физическим телом за единицу времени.
Отношение проделанного пути к единице времени.
Вопрос: Что изменяется во времени при механическом движении?
Координаты тела, следовательно, длина пути.
Кинопленку прокручивают через киноаппарат с определенной скоростью – 24 кадра в секунду. Что изменяется во времени?
Число кадров.
При дыхании человек потребляет кислород. Что изменяется во времени?
Количество литров.
Скорость какого–либо процесса – это изменение какой-либо физической величины за единицу времени. Что изменяется в ходе реакции? Это концентрация вещества.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Рассмотрим два примера (эксперимент проводит учитель).
На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO 4 . Что мы наблюдаем?
На примерах учащиеся судят о скорости реакций и делают соответствующие выводы.
В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций (два ученика записывают на доске уравнения):
CuSO 4 + 2КOH = Cu(OH) 2 + К 2 SO 4 ; Cu 2+ + 2OH - = Cu(OH) 2
Fe + CuSO 4 = FeSO 4 + Cu ; Fe0 + Cu 2+ = Fe 2+ + Cu0
Вопрос: Какой вывод по проведённым реакциям мы можем сделать?
Вопрос: Почему одна реакция идёт мгновенно, другая медленно?
Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
По результатам демонстрированного эксперимента учащиеся делают вывод:
реакция 1 – гомогенная, а реакция 2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
При рассмотрении вопроса о скорости реакции необходимо напомнить, что реакции в химии делятся на гомогенные и гетерогенные.
Определение: Реакции, которые протекают в однородной среде (нет поверхности раздела реагирующих веществ), например, в смеси газов или в растворах, называются гомогенными (от греч. гомо – «равный», «одинаковый»).
Определение: Гетерогенными называются реакции, которые идут между веществами в неоднородной среде (есть поверхность раздела реагирующих веществ). Например, на поверхности соприкосновения твердого вещества и жидкости, газа и жидкости, твердого вещества и газа и т.д. (от греч. гетеро – «разный», «другой»).
А) Скорость химической реакции для гомогенной реакции.
Рассмотрим понятие скорости химической реакции для гомогенной среды.
Вопрос: Назовите одно из условий осуществления химической реакции?
Одним из условий химической реакции является столкновение частиц.
Какая зависимость прослеживается между скоростью химической реакции и частотой столкновения частиц?
Чем чаще сталкиваются частицы, тем выше скорость химической реакции.
А теперь попробуйте сформулировать определение скорости химической реакции?
Скорость реакции – это число столкновений или число элементарных актов в единицу времени.
Так как подсчитать число соударений частиц не предоставляется возможным, нужно найти другую величину, которая изменяется во времени при протекании химической реакции. Исходные вещества превращаются в продукты реакции, следовательно, изменяется количество вещества.
Вывод: Скорость реакции – это изменение концентрации одного из вступивших в реакцию или образующегося в результате реакции вещества в единицу времени.
Если реакция протекает между веществами в гетерогенной системе, то реагирующие вещества соприкасаются между собой не по всему объему, а только на поверхности. Так, например, при горении угля, молекулы кислорода реагируют только с теми атомами углерода, которые находятся на поверхности. При измельчении угля его поверхность возрастает и скорость горения увеличивается. В связи с этим определение скорости гетерогенной реакции следующее:
Б) Скорость химической реакции для гетерогенной реакции.
Для гетерогенной реакции: Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности.
В математической форме это определение можно выразить так:
Вопрос: Как можно увеличить скорость реакции, если реагенты твердые?
Надо увеличить поверхность соприкосновения веществ, т.е. раздробить твердое вещество.
Следовательно, для гетерогенных реакций одним из факторов, которые определяют скорость химической реакции, является величина площади соприкосновения реагирующих веществ. Поэтому на производстве столь часто проводятся химические реакции в «кипящем слое». Твердое вещество для этой цели мелко дробят, измельчают почти до состояния пыли, а затем через него пропускают снизу второе вещество, как правило, газ. Прохождение его через мелкораздробленное первое вещество – реагент сопровождается иллюзией кипения. Например, в «кипящем слое» осуществляется обжиг мелко измельченного серного колчедана при производстве серной кислоты.
Знание скоростей химических реакций имеет очень большое практическое и научное значение.
На уроке мы пришли к выводу, что химическую реакцию необходимо рассматривать не только с качественной и количественной стороны, но учитывать и ее скорость.
Это необходимо, прежде всего, для того, чтобы управлять химической реакцией.
Не забывайте, что вы составляете кластер.
Факторы влияющие на скорость химической реакции.
Мы с вами рассмотрели, что такое скорость химической реакции, определили, что математически скорости гомогенной и гетерогенной реакции определяются по-разному.
Вопрос: От чего зависит скорость реакции?
Мы перечислили факторы, влияющие на скорость химической реакции. Исследовать достоверность этих утверждений вам предстоит самостоятельно, работая в группах.
Задание для групп:
Объяснить как влияет природа реагирующих веществ, площадь соприкосновения реагирующих веществ, концентрация и температура на скорость химической реакции.
Объяснения могут быть научными и образными, связанными с бытовыми примерами, художественными, можно зарисовать ситуацию, объясняющую эти явления.
Т.е. вам необходимо создать модель, которая должна объяснить, почему и как происходит изменение скорости реакции. Вашей моделью может быть: объяснение, картинка, сюжет. Для выработки образного объяснения можно применить АНАЛОГИЮ, т.е. на что похожа эта ситуация? Дается время для обсуждения в группах, (10 мин.)
Задание №1
Влияние природы реагирующих веществ на скорость гетерогенной химической реакции.
Задание: объяснить, почему на скорость химической реакции влияет природа реагирующих веществ.
Ход опыта: К одинаковым объемам соляной кислоты добавьте кусочки цинка и магния.
! Сравните скорости этих двух реакций.
! Объясните причину различия скоростей.
!
Задание №2
Влияние концентрации веществ на скорость химической реакции.
Задание: объяснить, почему на скорость химической реакции влияет концентрация исходных веществ.
Ход опыта: В 2 пробирки налейте одинаковые объемы раствора серной кислоты, одновременно прилейте растворы тиосульфата натрия разной концентрации (25г/л и 200г/л).
Реакция протекает по уравнению: Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3
H 2 S 2 O 3 = H 2 О + S+ SO 2
! Засеките время, через которое в пробирках появится осадок серы.
! Объясните причину разновременного появления осадка.
Задание №3
Влияние площади поверхности соприкосновения реагирующих веществ на скорость гетерогенной химической реакции.
Задание: объяснить, почему на скорость химической реакции влияет площадь поверхности соприкосновения реагирующих веществ.
Ход опыта: Поместите в одну пробирку кусочек мела, а в другую – измельченный мел и прилейте одинаковые объемы соляной кислоты.
! Сравните скорости реакций и объясните причину их различия.
! Напишите уравнение химических реакций.
Задание№4
Влияние температуры на скорость химической реакции.
Задание: объяснить, почему на скорость химической реакции влияет температура исходных веществ.
Ход опыта: Приготовьте гидроксид меди: смешайте раствор сульфата меди и гидроксид натрия. Полученный гидроксид меди разлейте в две пробирки. Одну из них нагрейте.
! Заметьте время, через которое появиться черный оксид меди при нагревании и без него.
! Сделайте вывод о зависимости скорости реакции от температуры.
Задание №5
Действие катализатора на скорость химической реакции.
Задание: объяснить, почему на скорость химической реакции влияет катализатор
Ход опыта: Раствор пероксида водорода разлейте в 2 пробирки. Одну из них нагрейте, в другую добавьте немного порошка оксида марганца (IV).
! Что наблюдаете? Объясните результат.
Анализ полученных данных.
Заслушивается выступление каждой группы. Внимательно слушаем и составляем кластер.
Например:
1. Аналогия на влияние природы реагирующих веществ:
Люди бывают разных характеров, разных темпераментов и от этого зависит скорость их работы, скорость сближения с другими людьми. Так и вещества имеют свои «характеры» и это влияет на скорость химических реакций.
2. Аналогия на влияние площади поверхности реагирующих веществ:
Из старой морской песни: «Мы - спина к спине у мачты, против тысячи -вдвоём!». Герои этой песни уменьшили площадь соприкосновения с врагами и уменьшили «скорость реакции» с ними, т. е. уменьшили возможность поражения.
3. Аналогия на влияние концентрации:
Чем больше вещества в единице объёма, тем больше столкновений между молекулами и выше скорость реакции. Это похоже на большой супермаркет, где много товара и много покупателей. В супермаркете продаётся больше товара, чем в маленьких специализированных магазинчиках, потому что покупатель «сталкивается» с большим количеством разных товаров.
Пробки на дорогах. Концентрация машин больше, а скорость движения –меньше. Комментарий учителя: да, такое тоже бывает в химии: при слишком большой концентрации веществ реакция не идёт, приходится разбавлять водой, чтоб молекулам «было, где разбежаться».
4. Аналогия на влияние температуры:
При повышении температуры повышается скорость движения молекул, поэтому они чаще сталкиваются и реагируют. Это похоже на дискотеку, где все двигаются, танцуют и поэтому легче знакомиться, чем, например, на собрании, где все сидят на своих местах.
5. Аналогия на влияние катализатора:
Два человека не дружат, может даже враждуют. Третий решил для пользы дела их сдружить. Идёт к одному из них, договаривается, объединяется с ним, потом вместе идут к другому, опять договариваются (при посреднике иногда легче договориться), посредник уходит, а первые двое становятся друзьями!
Вопрос: Как называют вещества, которые ускоряют химическую реакцию?
Учитель- Итак, мы выслушали каждую группу, вы отразили в своем выступлении один из факторов, влияющих на скорость химической реакции.
ВОПРОС: Скажите, для чего нам нужны такие образные представления?
Ответ: - Для лучшего запоминания и понимания происходящих химических процессов.
Учитель- Итак, мы посмотрели выступления каждой группы, каждая группа отразила в своем выступлении один из факторов, влияющих на скорость химической реакции. Давайте посмотрим какой кластер вы составили.
Закрепление и обобщение изученного.
Задача: а теперь для вас практическая задача:
В некоторой лаборатории долго пытались запустить химическую реакцию, но ничего не получалось, но потом у одного из лаборантов, когда он остался один в лаборатории - реакция пошла! Все сбежались, чтобы посмотреть, что он делает для запуска реакции, но к всеобщему разочарованию – опять ничего не получилось…. Оставшись наедине, он заново попытался провести реакцию и…она опять пошла! Стоило позвать всех, чтобы показать - реакция не идет…
В чем тут дело? Если бы лаборант применял только обычные средства для запуска реакции (нагрев, перемешивание, менял концентрацию), то это сработало бы и в присутствии сотрудников. А тут он и сам не понял, почему в одиночестве у него всё получается, а при коллегах – нет.
Для решения предлагаю вам ТРИЗовскую подсказку. Есть в ТРИЗ (теория решения изобретальских задач) такое волшебное слово МАТХЭМ, что означает перечень разных воздействий
Подсказка для решения задачи:
М- механическое (всякое перемешивание, давление)
А- акустическое (звуковое)
Т- тепловое
Х- химическое
Э- электрическое
М – магнитное
Заслушиваются ответы учащихся, если учащиеся не пришли к правильному ответу, то
дается правильный ответ (лаборант напевал, когда проводил эксперимент в одиночестве, а при всех, конечно, молчал…).
Оказывается, звук тоже может влиять на скорость химической реакции. Звук – это колебания, К какому фактору относится действие звука? Почему колебания могут влиять на запуск химической реакции?
Колебания помогают перемешивать жидкость, значит, увеличивают площадь поверхности реагирующих веществ.
Использование знаний о скорости реакции в быту
Почему продукты хранят в холодильнике?
Для консервирования продуктов используют ингибиторы.
Какое другое название можно дать этим веществам? Назовите вещества консерванты, которые мы применяем дома.
Домашнее задание. &15 б.у.; & 14 п.у.
Подведение итогов.
Рефлексия. А теперь я попрошу написать вас мне телеграмму. Это не должно быть больше 3 – 4 предложений телеграфного типа, в которых вы отразите своё впечатление от нашей работы сегодня.
Всем спасибо за сотрудничество.
Тема Скорость химических реакций и факторы на нее влияющие.
Тип урока: изучение нового материала
Вид урока: лекция
Класс : 9
Учитель химии ГБОУ СОШ № 1 города Байконур Гузикова Оксана Александровна
Цели урока.
Обучающие:
Дать понятие о скорости химических реакций и единицах ее измерения. Показать влияние на скорость реакций таких факторов как природа реагирующих веществ, их концентрация, площадь соприкосновения, использование катализаторов и температура. Познакомить учащихся с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо- и гетерогенные.
Развивающие:
Привитие навыков определения скорости химической реакции, используя закон действующих масс. Продолжение развитие общеучебных и предметных умений: анализировать, сравнивать, делать выводы. Развитие логико-смыслового мышления учащихся, памяти, химического языка.
Воспитательные:
Расширение кругозора, умение применять полученные знания на практике, самоусвоение лекционного материала. Воспитание культуры умственного труда.
Оборудование и реактивы:
Плакат по технике безопасности, формулы на ПП, проектор, лист-памятка с планом лекции.
Для демонстрационного эксперимента: раствор тиосульфата натрия, раствор серной кислоты, вода, пробирки.
Для лабораторного эксперимента: раствор соляной кислоты, порошок цинка, гранулы цинка, магний, железо, пробирки.
ДЕВИЗ УРОКА:
«Химическое превращение, химическая реакция – есть главный предмет химии» Н.Н. Семенов.
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Учитель
Здравствуйте ребята, садитесь.
Учитель
Дежурные назовите отсутствующих сегодня на уроке.
(учитель отмечает отсутствующих на уроке).
ОБЪЯСНЕНИЕ НОВОГО МАТЕРИАЛА
Учитель
Сегодня мы переходим к изучению нового раздела «Скорость химических реакций. Химическое равновесие».
На этом уроке мы поговорим о том, как определяется скорость химической реакции, и какие факторы могут ее изменить.
УЧИТЕЛЬ
На доске написаны две химические реакции.
Взаимодействие раствора соляной кислоты и цинка.
Взаимодействие раствора серной кислоты и раствора хлорида бария.
Учитель
Чем они отличаются?
Ученик
Они отличаются тем, что одна протекает между растворами, а вот во второй есть и раствор – соляная кислота, и металл – цинк.
Учитель
Значит, первая реакция протекает в одной среде, и эта реакция называется гомогенной, а во второй реакции принимают участие вещества разного агрегатного состояния, она носит название – гетерогенная. Примером гомогенных сред будут газ-газ, жидкость-жидкость. Перечислите примеры гетерогенных сред.
УЧЕНИК
Газ – твердое вещество, газ – жидкость, твердое вещество - газ.
УЧИТЕЛЬ
Правильно. Мы определим скорость химической реакции, запишем определение и соответствующие формулы.
Предмет изучения химии – химическая реакция. В результате химической реакции исчезают одни и образуются другие вещества. В процессе реакции изменяются количества вещества как реагентов (исходных веществ), так и продуктов (конечных веществ). Скорость этого изменения называется скоростью химической реакции. Химическая кинетика – учение о скоростях и механизмах химических реакций. (запишем это определение)
Таким образом, скорость химической реакции можно описать уравнением
r = / (1)
где r – скорость реакции (от англ. rate – скорость процесса, в отличие от ранее используемого обозначения для скорости реакции - velocity – скорость перемещения), (прописная греч. дельта ) – синоним слов «конечное изменение», (греч. ню ) – количество (моль) вещества-реагента или вещества продукта, (греч. тау ) – время (с), за которое произошло данное изменение.
При таком определении скорость реакции зависит от того, количество какого из участников реакции мы наблюдаем и измеряем. Очевидно, что для реакции, например:
2 H 2 + O 2 =2 H 2 O .
количество вещества превращающегося водорода в два раза больше, чем кислорода. Поэтому
r (H 2 ) = 2 r (O 2 ) = r (H 2 O ).
Уравнение реакции связывает величины скоростей, определенных по любому из веществ. Поэтому выбор последнего зависит от удобства и легкости экспериментального измерения его количества в реакционной системе.
На качественном уровне реакции могут быть классифицированы на быстрые, для измерения скорости которых необходимы специальные методы, например, взрыв гремучего газа, реакции в растворах электролитов; медленные, для измерения скорости которых нужны большие промежутки времени, например коррозия железа; и реакции, за течением которых мы можем наблюдать непосредственно, например взаимодействие цинка с соляной кислотой.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Если мы проводим одну и ту же реакцию с разными объемами или поверхностями соприкосновения реагентов, то для одной и той же реакции мы получим разные значения скорости, тем большие, чем больше вещества взято или чем лучше оно измельчено. Поэтому используют другое определение скорости реакции.
Скорость химической реакции – это изменение количества вещества какого-либо участка реакции в единицу времени в единице реакционного пространства (запишем это определение).
В гомогенной системе V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции, то уравнение имеет вид:
V = c / t (2)
где с – молярная концентрация вещества (моль/л).
Скорость реакции – изменение концентрации вещества в единицу времени.
В гетерогенной системе ( например, при горении твердого тела в газе или при взаимодействии металла с кислотой) реакция происходит на границе раздела между компонентами. Если площадь этой границы S , то уравнение скорости имеет вид:
V = n / S t (3)
Очевидно, что при таком определении (см. уравнения (2) и (3)) величина скорости реакции не зависит от объема в гомогенной системе и от площади соприкосновения реагентов (степени измельчения) в гетерогенной системе.
Какие же факторы влияют на скорость химической реакции?
ЗАПИШЕМ ОСНОВНЫЕ
Природа реагирующих веществ.
Влияние температуры.
Наличие катализатора.
На каждый случай приведем пример.
1. Влияние природы реагентов
Первым, и достаточно очевидным, фактором, определяющим скорость реакции, является природа реагентов. Выше на этой основе мы привели примеры реакций, текущих с разной скоростью.
Теперь проведем опыт, который экспериментально докажет это.
Учитель предлагает ребятам выполнить лабораторный опыт.
Для этого в 3 пробирки наливаем 1-2 мл раствора соляной кислоты и опускаем в каждую примерно по одинаковому кусочку металла: в первую – магний, во вторую – цинк, а в третью – железо.
Учитель
Во всех ли пробирках скорость выделения газа одинакова?
Ученик
Нет, в пробирках интенсивность выделения пузырьков разная. В первой пробирке газ выделяется очень быстро, во второй медленней, а в третье еще медленнее.
Учитель
Сделаем вывод
Ученик
Скорость химической реакции зависит от природы реагирующих веществ.
2. Влияние концентраций реагентов
Второй, и тоже достаточно очевидный, фактор – концентрация реагентов.
Проведем опыт
Учитель проводит демонстрационный опыт.
В три пробирки наливаем раствор тиосульфата натрия. В первую – 5 мл, во вторую – 2,5 мл, в третью - 1 мл. Далее во вторую и третью пробирки добавим по 5 мл воды. Затем вовсе пробирки, начиная с третьей, добавляем по 3 мл раствора серной кислоты. По времени появления и интенсивности выделившейся коллоидной серы и судят о влиянии концентрации тиосульфата натрия на скорость реакции.
Ученик
Скорость химической реакции зависит от концентрации реагентов
Учитель
А почему так происходит? Чем выше концентрация вещества, тем больше частиц в единице объема, тем чаще они сталкиваются. Количество это выражается так называемым законом действующих масс – скорость реакции пропорциональна концентрациям реагентов в некоторых степенях. Например, для следующих ниже уравнений реакций выражения скорости такие:
A = X , r = kc A ;
A + B = X, r = kc A c B ;
A + 2B = X, r = kc A c B c B = kc A c B 2 .
Величина k – коэффициент пропорциональности – называется константой скорости реакции и не зависит от концентраций. Численно этот коэффициент равен скорости реакций, если произведение концентраций реагентов равно 1. Когда сравнивают скорости разных реакций, то сравнивают именно их константы скоростей.
Важно отметить, что показатели степеней при концентрациях в приведенных ниже выражениях для скоростей химических реакций равны стехиометрическим коэффициентам только в редких случаях, когда реакция протекает в одну стадию (для так называемых элементарных реакций). На самом деле отдельная химическая реакция является такой же абстракцией, как и совершенно чистое химическое вещество. Другими словами, реальные химические превращения практически всегда включают в себя несколько реакций.
Скорость реакций, протекающих в несколько последовательных стадий, определяется самой медленной из этих стадий. Вспомним арабскую поговорку: «Караван идет со скоростью самого медленного верблюда».
Например, реакция
2 Fe 2+ + H 2 O 2 = 2 FeOH 2+
протекает по следующим стадиям:
1) 2 Fe 2+ + H 2 O 2 = 2 FeOH 2+ + OH .
k 1 = 60 л/(моль . с);
2) OH . + Fe 2+ = FeOH 2+ , k 2 = 60 000 л/(моль . с).
Более медленная стадия – первая. Поэтому уравнение скорости данной реакции –
r = k 1 c (Fe 2+ ) c (H 2 O 2 ),
а не r = kc 2 (Fe 2+ ) c (H 2 O 2 ).
О таких сложных процессах мы будем еще говорить более подробно в 11 классе.
3. Влияние температуры.
Учитель
Влияние температуры на протекание химической реакции двояко. Во- первых температура может влиять на состав продуктов, а во-вторых - подавляющее большинство реакций ускоряются при увеличении температуры. Почему? Потому что с повышением температуры быстро растет число, так называемых «активных» молекул, т.е. молекул, обладающих энергией, большей, чем энергия активации.
Энергия активации – разность между средней энергией молекул при данной температуре и той энергией, которой они должны обладать, чтобы вступить в химические реакции.
Влияние температуры на скорость химической реакции иллюстрирует правило Вант – Гоффа
ОПРЕДЕЛЕНИЕ
При изменении температуры реакции на каждые 10 градусов скорость реакции изменяется в 2-4 раза (Формула на доске)
Учитель
Если температуру увеличивать, что произойдет со скоростью химической реакции.
Ученик
Скорость реакции увеличится при повышении температуры на каждые 10 градусов в 2-4 раза.
Учитель
Если температуру уменьшить, что произойдет со скоростью химической реакции.
Ученик
Скорость уменьшится при понижении температуры на каждые 10 градусов в 2-4 раза.
4. Площадь поверхности соприкосновения.
Учитель
Теперь перейдем к площади поверхности соприкосновения.
Лабораторный опыт. Памятка по соблюдению правил техники безопасности.
В две пробирки нальем соляную кислоту, в первую добавим порошок цинка, а во вторую гранулу. Запишите уравнение реакции. Определите ее тип. Где реакция проходит быстрее? Почему?
Ученик записывает реакцию. Она является реакцией замещения.
Реакция проходит быстрее в первой пробирке. Ведь там больше площадь поверхности соприкосновения.
Учитель
Правильно.
5. Катализатор
Последний фактор – это наличие специальных веществ - катализаторов. Химическая реакция – сложный процесс, в котором могут принимать участие не только вещества реагенты, но и другие присутствующие в системе вещества. Если они заметно изменяют скорость химической реакции, то их и называют катализаторами. Об этих веществах и о катализе мы подробно погорим на следующем уроке.
ЗАКРЕПЛЕНИЕ МАТЕРИАЛА
Учитель
Какую новую величину мы изучили на сегодняшнем уроке?
Ученик
Мы ознакомились со скоростью химической реакции.
Учитель
Какие виды сред вы узнали?
Ученик
Гомогенную и гетерогенную.
Учитель
Одинаково ли определяется скорость в разных средах?
Ученик
Нет, по разному.
Учитель
Как определяется скорость в гомогенной среде?
Ученик
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции
Учитель
Учитель
Как определяется скорость в гетерогенной среде?
В гетерогенной системе реакция происходит на границе раздела между компонентами. Если площадь этой границы S .
Учитель
В каких единицах она измеряется?
Какие факторы влияют на скорость химической реакции? Перечислите их.
Ученик
Природа реагирующих веществ.
Концентрация реагирующих веществ.
Температура.
Площадь поверхности соприкосновения.
Наличие катализатора.
IY . ОБОБЩЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Сегодня на уроке мы изучили понятие скорость химической реакции. Рассмотрели как определяется скорость химической реакции в гомогенной и гетерогенной системах. Определили факторы, которые могут повлиять на скорость химической реакции.
Y . ДОМАШНЕЕ ЗАДАНИЕ
Основные определения дома выучить. А так же на столах у вас есть задания, они трехуровневые. Как всегда, каждый для себя выбирает соответствующий уровень, который на данном этапе обучения вам под силу выполнить.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ 6.4.2 № 86
Пояснительная записка.
Данная разработка учебного занятия относится к разделу «Химические превращения», изучаемого в 11 классе. В ходе подготовки урока по теме были соблюдены общие требования к формированию занятий, таких как соотношение принципов наглядности, доступности и научности предлагаемого материала, соблюдение культуры безопасного обращения с веществами и привитие целостного миропонимания химических явлений и процессов, прогнозирования и планирования результатов урока.
Четко сформулированные цели и задачи урока реализуются использованием различных методов, форм и методических приемов обучения. Предложен урок открытия новых знаний с элементами исследования, поскольку на данном этапе обучающиеся получат достаточное количество теоретических понятий, которые закрепляются в ходе выполнения ими практической части урока. Использованы следующие формы организации учебной деятельности: фронтальная, групповая, индивидуальная. Учителю отводится роль в регулировании процесса обучения, направление обучающихся, контроле за их наблюдениями, коррекции и дополнении полученных ими результатов и анализе последних.
Планируемые результаты: сформировать основные понятия по теме, понимать значение влияния различных факторов на скорость химической реакции. Понимать возможность управления химической реакции с помощью изменениия условий ее протекания. Развить умение планировать и осуществлять химический эксперимент, умело фиксируя результаты, и анализировать их. Осознавать целостность протекающих химических процессов и явлений, осуществлять варьирование понятиями в применении к явлениям экологической и межпредметной сфер.
Тема урока : скорость химических реакций.
Цели урока : изучить сущность понятия: скорость химических реакций, выявить зависимость этой величины от различных внешних факторов.
Задачи урока:
обучающая Что такое скорость химических реакций и от каких факторов она зависит.
развивающая Обучающиеся учатся обрабатывать и анализировать экспериментальные данные, выявляют сущность химической реакции, выясняют взаимосвязь между скоростью химической реакции и внешними факторами
воспитательная Обучающиеся развивают коммуникативные умения в ходе парной, коллективной работы. Привлекают средства химии к пониманию процессов, происходящих в окружающем мире. В ходе практической работы осознают обязательность точного выполнения инструкций для получения результата.
Тип урока : урок открытия новых знаний с элементами исследования.
Метод обучения : частично поисковый , форма организации : индивидуальная, групповая, фронтальная, коллективная
Литература для учителя и обучающегося:
2. Г.Е.Рудзитис, Ф.Г.Фельдман Химия. 11 класс. Базовый уровень/ Учебник для общеобразовательный учреждений.
3. Гара Н.Н. Уроки химии 11 кл.
4. Гара Н.Н., Габрусева Н.И. Химия. Задачник с «помощником» 11 кл.
Средства обучения: химические вещества и оборудование для опытов, мультимедийная приставка, компьютер.
Этапы урока | Обоснование деятельности учителя | Прогнозируемая деятельность обучающихся | Формируемые УУД |
|||||||||||||||||||||||
Взаимное приветствие обучающихся и учителя; фиксация отсутствующих; проверка готовности обучающихся к уроку. | Подготовить обучающихся к работе | Готовность класса к работе | Готовность к сотрудничеству и сотворчеству с учителем |
|||||||||||||||||||||||
Вспомним:
| Подвести обучающихся к рассмотрению цели и задач урока. Обеспечить мотивацию и принятие обучающимися задачи урока При обсуждении вопроса (2) необходимо подчеркнуть, что химическая реакция возможна только при столкновении молекул | Активная работа обучающихся показывает их готовность к восприятию темы урока Из личного жизненного опыта обучающиеся предполагают, что продолжительность различных реакций разная | Уметь участвовать в коллективном обсуждении, аргументировать свою позицию. Уметь пользоваться знаниями и бытовыми наблюдениями |
|||||||||||||||||||||||
Записываем тему урока «Скорость химических реакций». Формулируем задачу урока: выяснить, что такое скорость химической реакции и от каких факторов она зависит. В ходе урока мы познакомимся с теорией вопроса «скорость химической реакции». Затем на практике подтвердим некоторые наши теоретические предположения . | Озвучить цель урока и примерный план его проведения. | |||||||||||||||||||||||||
Рассмотрим два примера. На столе – две пробирки, в одной – раствор щелочи (NaOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO 4 . Что мы видим? В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет. Составим уравнения реакций (два обучающихся записывают на доске уравнения):
Cu 2+ + 2OH - = Cu(OH) 2
Fe 0 + Cu 2+ = Fe 2+ + Cu 0 Отметим, что реакция 1) – гомогенная, а реакция 2) – гетерогенная. Это важно для нас. А как долго длится реакция и от чего это зависит? На эти вопросы мы попытаемся ответить в ходе нашего урока. Учение о скоростях и механизмах химических реакций называется химической кинетикой . | Необходимо подтвердить предположения обучающихся химическим экспериментом | По результатам демонстрационного эксперимента обучающиеся убеждаются в справедливости своих предположений | Уметь самостоятельно либо с помощью учителя фиксировать результаты демонстрации, делать умозаключение, планировать возможный этап изучения. Уметь записывать уравнения химических реакций. |
|||||||||||||||||||||||
Обратимся к понятию «скорость». Вам известны такие сочетания, как скорость движения, скорость чтения, скорость наполнения бассейна и т. д. В общем случае, что такое скорость? Изменение какого-либо фактора за единицу времени. А какой же фактор изменяется, когда речь идет о скорости реакции? Мы уже сказали, что химическая реакция происходит при столкновении частиц. Тогда, очевидно, что скорость реакции тем больше, чем чаще сталкиваются частицы. При столкновении частиц исходных веществ происходит образование новых частиц - продуктов реакции. Что же изменяется с течением времени в химической реакции? Изменяется количество исходных веществ и изменяется количество продуктов реакции. Если мы отнесем количество вещества к единице объема, мы получим молярную концентрацию вещества. Молярная концентрация вещества измеряется в моль/л. чтобы определить скорость реакции, необходимо иметь данные об измении концентрации какого-либо компонента реакции через определенные промежутки времени. На доске записано уравнение реакции I 2 (газ) + H 2 (газ) + 2HI(газ) и приведена таблица изменения концентрации йода во времени (правый столбец – изменение концентрации HI пока не заполнен) | Обеспечить осмысленное восприятие знаний Установить фактор, по которому можно судить о скорости реакции Введение понятия о молярной концентрации и единицах ее измерения | Активные действия обучающихся с объектом изучения В ходе беседы обучающиеся приходят к выводу о связи скорости реакции с концентрацией участвующих в реакции веществ | Уметь выстраивать причинно-следственные связи, осуществлять требуемые сравнение, обобщение и зависимость. |
|||||||||||||||||||||||
Строим график изменения концентрации йода во времени С HI, моль/л 3 1,2 1,0 2 1,0 0,8 0,8 0,6 0,6 0,4 3 0,4 0,2 0,2 0 5 10 15 20 Время, с | График изменения концентрации реагирующего вещества во времени дает обучающимся возможность самостоятельно определить скорость реакции и проследить, как она изменяется в ходе реакции | Формирование исследовательских умений – строят график по данным эксперимента | Уметь фиксировать зависимость скорости реакции от различных факторов. Формулировать соответствующие выводы |
|||||||||||||||||||||||
Кривая изменения концентрации реагирующего вещества или продукта реакции во времени называется кинетической кривой . Скорость химической реакции – это изменение концентрации одного из реагирующих веществ за единицу времени. C 2 - c 1 ∆c 0,3 - 1 v = = = = - 0,03 (моль/л · с) T 2 – t 1 ∆t 20 – 0 Принято считать скорость реакции положительной величиной, знак «минус» говорит о том, что функция зависимости концентрации I 2 от времени убывающая. Из графика следует, что с течением времени уменьшается не только концентрация, но и скорость реакции. Подтвердим это расчетами. Определим скорость для разных участков кинетической кривой: на участке 1: v = 0,08 моль /(л · с), на участке 2: v = 0,035 моль/(л · с), на участке 3: v = 0,01 моль/ (л · с) Какие выводы следуют из анализа кинетической кривой? – Концентрация реагирующего вещества уменьшается по мере протекания реакции. Скорость реакции с течением времени уменьшается. Очевидно, «скорость реакции» - это средняя скорость процесса в определенный промежуток времени, что чем меньше промежуток времени, тем точнее значение скорости. Заполним правый столбец таблицы значениями концентрации продукта реакции HI. При определении значений руководствуемся уравнением реакции. Строим кинетическую кривую относительно продукта реакции, определим скорости реакции для участков кривой 1, 2 и 3. Приходим к выводу, что скорость по компоненту HI в два раза больше, чем по компоненту I 2 . Это можно прогнозировать, исходя из уравнения реакции. дополнительный анализ кинетической кривой показал нам, что
| Поэтапный анализ кинетической кривой приводит к осмысленному пониманию изучаемого материала, исключает формализм знаний Построение кинетической кривой по продукту реакции показывают, что накопление продукта реакции происходит постепенно, по мере расходования исходных веществ Необходимо обратить внимание на физическую сущность стехиометрических коэффициентов в уравнении химической реакции | Самостоятельно формулируют понятие «скорость реакции» Самостоятельно рассчитывают скорость для всей кинетической кривой и отдельных ее участков. Обучающиеся сами выводят единицы скорости реакции Анализируют результаты полученных расчетов. формулируют выводы | ||||||||||||||||||||||||
На доске плакат: Химическая реакция идет по схеме А + В = 2С 2А + В = 2С | Оценить правильность и осознанность усвоения нового учебного материала, выявить и устранить пробелы и неверные представления | Заполняют таблицу | Уметь применять полученные знания для решения простых задач. Аналировать правильность выполения последовательности действий. Уметь участвовать в обсуждении проблемы, выражать собственное мнение о полученном результате. |
|||||||||||||||||||||||
Задача: в каком из сосудов одинаковой емкости реакция протекает с большой скоростью, если за одно и то же время в первом сосуде образуется 10 г фторводорода, а во втором – 53 г иодоводорода? | Закрепить полученные знания | Самостоятельное выполнение заданий с взаимной проверкой результата выполнения. | Уметь самостоятельно решать задания по теме. Анализировать правильность выполнения задания. |
|||||||||||||||||||||||
Подведем основные итоги. Сформулируем их и запишем в тетрадь | Сформировать умение обобщать полученную информацию и выделять главное | Самостоятельная формулировка выводов. Выявление общего эмоционально-продуктивного фона урока. | Уметь обобщить и систематизировать полученную информацию. Участвовать в обсуждении, уметь выражать свои мысли. |
|||||||||||||||||||||||
Предлагается разноуровневое задание по карточкам: 1) обязательное: §.12, у 1-6 с. 62 2) углубленное: §. 12, з1-4 с.63 3) творческое: Рассмотреть реакции получения серной кислоты из пирита с точки зрения зависимости скорости хим.реакции от разл. факторов. | Сопровождение записанного задания комментариями для различных уровней. | Выбор одного из видов задания для домашней работы. Извлечение необходимой информации и фиксация ее в дневник. | Правильно и с удовольствием выполненное домашнее задание. |
|||||||||||||||||||||||